俀擭丂壔妛嘥B丂幚尡
亂幚尡戣栚亃 拞榓揌掕
亂幚尡擔亃丂丂丂丂擭丂丂丂寧丂丂丂擔丂丂丂梛擔丂丂丂峑帪
亂幚尡幰巵柤亃丂丂丂丂丂擭丂丂丂慻丂丂丂斣丂丂丂斍乮丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂乯
亂嫤摨幚尡幰亃(丂丂丂丂丂丂丂丂丂丂丂丂丂)(丂丂丂丂丂丂丂丂丂丂丂丂丂)(丂丂丂丂丂丂丂丂丂丂丂丂)(丂丂丂丂丂丂丂丂丂丂丂丂)
亂栚揑亃 拞榓揌掕偵傛偭偰丄巗斕偺怘恷拞偺恷巁偺擹搙傪挷傋傞丅
亂弨旛亃 怘恷侾侽倣倢丄擹搙婯掕偺悈巁壔僫僩儕僂儉悈梟塼乮侽丏侾倣倧倢/
l 慜屻偱惓妋側抣偺傕偺乯丄僼僃僲乕儖僼僞儗僀儞梟塼丄忲棷悈
儊僗僼儔僗僐乮侾侽侽倣倢乯丄儂乕儖僺儁僢僩乮侾侽倣倢乯丄價儏儗僢僩乮俀俆倣倢乯丄
丂丂丂價儏儗僢僩戜丄嶰妏僼儔僗僐乮僐僯僇儖價乕僇乕乯丄價乕僇乕乮俆侽倣倢乯俀屄丄傠巻
亂曽朄亃
嘆丂巗斕偺怘恷傪儂乕儖僺儁僢僩偱惓妋偵侾侽倣倢偲傝丄侾侽侽倣倢偺儊僗僼儔僗僐
丂偵擖傟傞丅儊僗僼儔僗僐偺昗慄傑偱忲棷悈傪壛偊丄傛偔崿崌偝偣偰擹搙傪
丂侾/侾侽偵偟偨帋椏悈梟塼傪偮偔傞丅
乮拲堄乯 儂乕儖僺儁僢僩偼彮検偺怘恷丄儊僗僼儔僗僐偼忲棷悈偱愻偭偰 梡偄傞丅
嘇 悈巁壔僫僩儕僂儉悈梟塼傪價乕僇乕偵偲傝丄彮偟偢偮拲堄偟偰價儏儗僢僩
偵擖傟傞丅偦偺壓偵嬻偺價乕僇乕傪抲偒丄僐僢僋傪奐偄偰丄價儏儗僢僩偺愭
抂傑偱悈梟塼傪枮偨偡丅偙偺偲偒偺塼柺偺栚惙傝倴侾傪侾/侾侽栚惙傝傑偱
撉傒庢傞丅
乮拲堄乯 價儏儗僢僩偼彮検偺悈巁壔僫僩儕僂儉悈梟塼偱愻偭偰偐傜梡偄傞丅
嘊 嶰妏僼儔僗僐偵丄曽朄嘆偱偮偔偭偨帋椏悈梟塼傪儂乕儖僺儁僢僩偱侾侽倣倢偲傞丅
巜帵栻偲偟偰丄僼僃僲乕儖僼僞儗僀儞梟塼傪侾乣俀揌壛偊傞丅
乮拲堄乯 儂乕儖僺儁僢僩偼丄曽朄嘆偱偮偔偭偨帋椏悈梟塼丄嶰妏僼儔僗僐偼
忲棷悈偱愻偭偰梡偄傞丅
嘋 恾偺傛偆偵丄嶰妏僼儔僗僐偺壓偵傠巻傪抲偒丄價儏儗僢僩偐傜彮偟偢偮悈巁
壔僫僩儕僂儉悈梟塼傪揌壓偡傞丅偦偺偮偳丄嶰妏僼儔僗僐傪傛偔怳傝崿偤丄
悈梟塼偑旝愒怓傪懷傃丄悢夞怳偭偰傕徚偊側偔側傞偲偙傠偱揌壓傪傗傔傞丅
偦偺偲偒偺塼柺偺栚惙傝倴俀傪撉傓丅
嘍 曽朄嘊乣嘋偺憖嶌傪偝傜偵俀夞峴偄丄悈巁壔僫僩儕僂儉悈梟塼偺揌壓検偺
暯嬒抣傪媮傔傞丅
亂曗懌亃 嫟愻偄傪偡傞丅
亂寢壥亃 幚尡寢壥傪昞偵傑偲傔傞丅
| 幚尡夞悢 |
侾 |
俀 |
俁 |
|
偼偠傔偺栚惙傝倴侾 |
|||
|
揌掕屻偺栚惙傝倴俀 |
|||
|
揌壓検倴俀亅倴侾乮倣倢乯 |
|||
|
暯嬒揌壓検乮倣倢乯 |
丂
丂
丂
丂
丂
丂
丂
亂峫嶡亃
侾幚尡偵梡偄偨怘恷拞偺巁偑丄偡傋偰恷巁俠俫俁俠俷俷俫偱偁傞偲偟偰丄師偺抣傪媮傔傞丅
乮傾乯偆偡傔偨怘恷拞偺恷巁偺擹搙偼壗倣倧倢/
l 偐丅丂
乮僀乯傕偲偺怘恷侾
l 拞偵娷傑傟偰偄傞恷巁偼壗倗偐丅丂
俀 曽朄嘆偱丄儂乕儖僺儁僢僩偼彮検偺怘恷偱愻偄丄偦偺傑傑梡偄傜傟傞丅偦偺棟桼傪愢柧偣傛丅
丂
俁丂偙偺幚尡偱丄儊僗僼儔僗僐偲嶰妏僼儔僗僐偼忲棷悈偱偸傟偰偄偰傕偦偺傑傑巊梡偟偰偐傑傢側偄丅
丂偦偺棟桼傪愢柧偣傛丅
丂
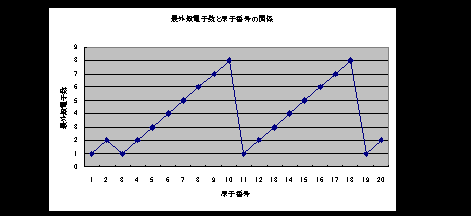
係 偙偺幚尡偺拞榓揌掕嬋慄偼丄塃恾偺傛偆偵昞偝傟傞丅拞榓揰偺
倫俫偑傾儖僇儕惈懁偵偁傞棟桼傪愢柧偣傛丅
丂
俆 偙偺幚尡偺巜帵栻偲偟偰儊僠儖僆儗儞僕傪梡偄偨偲偡傞偲丄幚尡
寢壥偼偳偺傛偆偵側傞偲梊憐偝傟傞偐丅
丂
亂姶憐亃
丂
亂幚尡偱媈栤偵巚偭偨偙偲亃